Х. Л. Менкен: «Никогда не верь ничему, что слышишь, и только половине того, что видишь».
«Первой жертвой, когда приходит пЛандемия или война, становится правда».
В «Искусстве войны» Сунь-Цзы заявил: «Вся война основана на обмане»
Вторая из серии статей, в которых подробно рассматривается каждый аспект пЛандемии.
Наши правительства заставляют нас вводить яд в наши тела.
Исторический провал вакцин против атипичной пневмонии.
С тех пор, как был обнаружен SARS-CoV, исследователи вакцин пытались разработать вакцину против SARS. В течение двух десятилетий это исследование не дало никаких результатов.
Одно исследование вакцины против атипичной пневмонии, датированное 2012 годом, показывает результаты использования инактивированной цельновирусной вакцины или вакцины на основе вирусоподобных частиц в мышиной модели. У животных развилась иммунопатология Th2 и эозинофилия в легких после заражения живым вирусом.
PLOS One – Иммунизация вакцинами против коронавируса SARS приводит к легочной иммунопатологии при заражении вирусом SARS.
Все вакцины индуцировали нейтрализующие сыворотку антитела при увеличении доз и/или квасцов, значительно повышающих ответы. Значительное снижение SARS-CoV через два дня после заражения наблюдалось для всех вакцин и ранее живого SARS-CoV. У всех мышей наблюдались гистопатологические изменения в легких через два дня после заражения, включая всех животных, вакцинированных (Balb/C и C57BL/6) или получивших живой вирус, противогриппозную вакцину или PBS, что позволяет предположить, что инфекция имела место у всех. Гистопатология, наблюдаемая у животных, получивших одну из вакцин против SARS-CoV, всегда представляла собой иммунопатологию Th2-типа с выраженной инфильтрацией эозинофилов, что подтверждалось специальным окрашиванием эозинофилов. В патологических изменениях, наблюдаемых во всех контрольных группах, не было заметного присутствия эозинофилов.
Эозинофилы являются частью подкатегории лейкоцитов, известных как гранулоциты. В крови обнаруживаются три основных типа гранулоцитов: нейтрофилы, эозинофилы и базофилы, а в тканях дополнительно обнаруживаются тучные клетки.

Гранулоциты борются с инфекцией, развертывая гранулы, содержащие различные виды деструктивных ферментов. Как описано в части I этой серии статей, нейтрофилы агрессивно борются с патогенами путем диспергирования супероксиддисмутазы и миелопероксидазы с образованием пероксида и отбеливателя, денатурируя и уничтожая патогены. Они также поглощают патогены и подвергают их воздействию этих ферментов, садистски растворяя их. Это на самом деле удивительно жестоко. Формирование нейтрофильных внеклеточных ловушек не имеет макромасштабной аналогии, которая не звучит нелепо. Нейтрофилы фактически выбрасывают разрушительные ферменты вместе с гистонами и собственной ядерной ДНК, когда они это делают. Представьте человека, который пьет кислоту, а затем кричит, вырывает свои кислые кишки и бросает их в вас, чтобы убить.
Эозинофилы специализируются на опосредовании аллергических реакций и запуске иммунных реакций на паразитарные инфекции. Они патрулируют вокруг и выделяют воспалительные цитокины, когда замечают что-то неладное.
Базофилы — самый редкий тип, их функция до конца не изучена наукой. Известно, что они содержат гепарин, гистамин и серотонин и могут иметь иммуноопосредующее действие.
Зрелые гранулоциты терминально дифференцированы и не делятся; их незрелые предшественники делятся и реплицируются в костном мозге.
Зрелые гранулоциты немного похожи на сардаукаров:
Это фанатичные воины с разрисованными лицами, хорошо подготовленные к неизбежности смерти.
Слово «воспаление» в основном означает то, что вызывает эти клетки (наряду с различными клетками адаптивной иммунной системы). Когда воспаление является системным и приводит к органной недостаточности, мы называем это сепсисом или синдромом системной воспалительной реакции (SIRS). Сепсис — это не шутки. Он постоянно помещает людей в отделение интенсивной терапии, и его очень трудно лечить.
Да, ваша собственная иммунная система вооружена до зубов и вполне способна вас убить.
Врожденные и адаптивные иммунные системы.
Иммунная система делится на две основные части. Врожденная иммунная система и адаптивная иммунная система. Все реакции на заражение патогеном протекают одинаково; во-первых, поврежденные клетки подают сигналы опасности и производят воспалительные цитокины. Эти цитокины действуют как дымовой сигнал, привлекая вышеупомянутых фанатичных воинов с раскрашенными лицами — лейкоциты. Нейтрофилы атакуют болезнетворные микроорганизмы изо всех сил с помощью разрушительных ферментов, макрофаги следуют за ними, чтобы поглотить и растворить остатки, а ваши собственные клетки съеживаются перед этим ужасающим проявлением огневой мощи, отчаянно пытаясь выжить, используя антиоксидантные ферменты и пути выживания для детоксикации себя. антисептический суп из гранул, которые производят иммунные клетки.
Однако цель этой первоначальной контратаки состоит только в том, чтобы остановить патоген, в то время как прилежные стратеги адаптивной иммунной системы, Т- и В-лимфоциты и дендритные клетки, придумывают более постоянное решение в виде антител. Как только организм успешно начинает вырабатывать антитела, эти антитела прикрепляются к внешним белкам патогена, и их места связывания, такие как маленькие мины и макрофаги, направляются к нейтрализованным патогенам, чтобы поглотить и уничтожить их, навсегда остановив инфекцию.
Цель вакцины, вообще говоря, состоит в том, чтобы вызвать адаптивный иммунный ответ без недостатков полномасштабной инфекции. Это достигается путем использования цельного убитого или живого аттенуированного вируса или белковых субъединиц этого вируса для представления антигенов иммунной системе и стимуляции гуморального ответа. Вакцины не служат никакой другой цели. Единственная цель вакцины — получить адаптивный иммунный ответ без инфекции или воспаления, дав иммунной системе тренировочную мишень, чтобы она распознавала настоящий патоген с первого взгляда.
Если вакцина вырабатывает антитела, которые не дают иммунитета к патогену, она бесполезна. Если вакцина не вырабатывает иммунитет и фактически стимулирует воспалительную реакцию, повреждающую ткани, она более чем бесполезна.
Типы вакцин.
Существует четыре основных типа вакцин; Живая аттенуированная вакцина (LAV), инактивированная, анатоксин и субъединица.
В живых аттенуированных вакцинах используется ослабленный вирус, в инактивированных вакцинах используется убитый вирус, в токсоидных вакцинах используется инактивированный токсин патогена, а в субъединичных вакцинах используется белок. Очень часто в эти вакцины включают различные токсичные адъюванты, стимулирующие более сильный иммунный ответ на антигены, представленные в вакцине.
По сути, вирус представляет собой совокупность белков, встроенных в мембрану (или нет; существуют безоболочечные «голые» вирусы без липидной мембраны), покрывающих геном и действующих как механизм доставки этого генома, вводя его в живые организмы. клетки для производства большего количества вирионов. Основными антигенами-мишенями вируса обычно являются внешние структурные белки, которые он использует для связывания и слияния с живыми клетками. Например, в случае SARS-CoV-2 это будет Spike.
В последние годы появились два новых типа вакцин: вирусные векторные вакцины и мРНК-вакцины. В этих вакцинах используется совершенно другой подход; концепция человеческой клетки как биореактора. По сути, они доставляют генетический материал в клетки человека, чтобы заставить их производить вирусные белки и представлять их на своей поверхности, что, в свою очередь, должно стимулировать иммунный ответ. Первые вирусные векторные вакцины против Эболы были доступны в 2010-х годах с использованием вируса везикулярного стоматита в качестве вектора.
Для COVID-19 был разработан ряд вакцин на основе аденовирусных векторов, таких как вакцина Janssen/J&J COVID-19 Ad.26.COV2.S, вакцина AstraZeneca COVID-19, известная под торговыми названиями Vaxzevria или Covisield, и Спутник-В Гамалей. К ним присоединяются две мРНК вакцины: Spikevax/mRNA-1273 компании Moderna и Comirnaty/BNT162B2 компании Pfizer-BioNTech.
Технически нет необходимости делать это с помощью живых клеток организма. Вполне возможно произвести субъединичную вакцину против SARS-CoV-2, вставив ген спайка SARS-CoV-2, например, в кишечную палочку или спирулину или некоторые другие бактерии, культивируя их в чане биореактора, а затем сбор и очистка белка. Именно так производятся рекомбинантный инсулин и различные другие биопрепараты.
В случае вакцин с вирусным вектором и мРНК вакцина представляет собой генетический код, хотя и доставляется двумя разными механизмами. Мышечные клетки дельтовидной мышцы реципиента являются биореакторами. Вакцины с вирусным вектором вводят генетический материал в клетки посредством дефектного по репликации рекомбинантного аденовируса, а мРНК вакцины вводят матричную РНК в клетки с помощью синтетических липидных наночастиц, наполненных матричной РНК, которые сливаются с клетками и высвобождают свой груз.
пЛандемия COVID-19 ознаменовала собой первое в истории крупномасштабное использование вирусных векторов и мРНК-вакцин. Эти вакцины прошли ускоренные испытания и были проданы правительствам по соглашениям о закупках, которые защищали их производителей от любой ответственности за их неудачу.
Создание инертного спайка и обход иммунной системы.
SARS-CoV-2 Spike — очень неприятный вирусный гликопротеин. Вся его цель состоит в том, чтобы слиться с человеческим ACE2, сбросить его тримерные головки, а затем сблизить вирус и клеточные мембраны. Он делает это, используя молекулярную механику в крошечном масштабе, подобно гидравлической руке экскаватора. Прежде чем его можно было использовать в качестве вакцинного антигена, его нужно было сделать инертным. Исследователи предложили сделать это путем замены пролина в последовательности Spike, зафиксировав тримерные головки в конформации «вниз» до слияния. В результате этого исследования были созданы варианты Spike с блокировкой предварительной сварки, такие как 2P и HexaPro:
bioRxiv (препринт) — Структурный дизайн шипов SARS-CoV-2, стабилизированных до слияния
Пандемия COVID-19, вызванная новым коронавирусом SARS-CoV-2, привела к ускорению усилий по разработке терапевтических средств, средств диагностики и вакцин для смягчения последствий этой чрезвычайной ситуации в области общественного здравоохранения. Ключевой целью этих усилий является белок шипа (S), большой тримерный слитый белок класса I, который является метастабильным и его трудно рекомбинантно продуцировать в больших количествах. Здесь мы разработали и экспрессировали более 100 структурно-ориентированных вариантов шипа на основе ранее определенной крио-ЭМ структуры шипа до слияния SARS-CoV-2. Биохимическая, биофизическая и структурная характеристика этих вариантов выявила многочисленные индивидуальные замены, которые увеличили выход и стабильность белка. Лучший вариант, HexaPro, имеет шесть полезных замен пролина, что приводит к примерно в 10 раз более высокой экспрессии, чем его родительская конструкция, и способен выдерживать тепловой стресс, хранение при комнатной температуре и многократное замораживание-оттаивание. Крио-ЭМ-структура HexaPro с разрешением 3,2 Å подтвердила, что она сохраняет конформацию шипа до слияния. Высокопроизводительное производство стабилизированного спайкового белка префузии ускорит разработку вакцин и серологических средств диагностики SARS-CoV-2.
Вообще говоря, предполагается, что блокировка Spike в конформации перед слиянием позволяет ему быть представленным иммунной системе в качестве жизнеспособного вакцинного антигена, но предотвращает его токсические или цитопатические эффекты в результате нежелательной активации и слияния.
Spike также имеет трансмембранный домен в своем хвосте, в субъединице S2, поэтому он станет мембраносвязанным белком после экспрессии клетками дельтовидных мышц. Теоретически это предотвратит его экспорт этими клетками и миграцию по всему телу.
Acta Pharmacologica Sinica — Структурные и функциональные свойства шиповидного белка SARS-CoV-2: потенциальная разработка антивирусного препарата для лечения COVID-19.
Имея размер 180–200 кДа, белок S состоит из внеклеточного N-конца, трансмембранного (ТМ) домена, закрепленного в вирусной мембране, и короткого внутриклеточного С-концевого сегмента [ 11 ]. S обычно существует в метастабильной конформации до слияния; как только вирус взаимодействует с клеткой-хозяином, происходит обширная структурная перестройка белка S, позволяющая вирусу сливаться с мембраной клетки-хозяина. Шипы покрыты молекулами полисахаридов, чтобы замаскировать их, избегая наблюдения иммунной системы хозяина во время проникновения [ 12 ].
Затем этот Spike был закодирован в ДНК для вирусных векторных вакцин и в мРНК для вакцин на основе липидных наночастиц. Для мРНК-вакцин были необходимы некоторые средства стабилизации мРНК и уклонения от иммунного обнаружения. ДНК и информационная РНК состоят из длинных цепей пяти различных азотистых оснований; аденин (А), цитозин (С), гуанин (Г), тимин (Т) и урацил (У). Для вакцин мРНК они взяли урацил и заменили его псевдоуридилилом (Ψ). Это позволило ему избежать обнаружения толл-подобными рецепторами, типом рецептора распознавания образов, который запускает воспаление при активации.
Псевдоуридилирование имеет еще один эффект; он делает мРНК молекулярно стабильной и заставляет ее сопротивляться деградации.
Frontiers – решающий вклад псевдоуридина в мРНК вакцины против COVID-19.
Хотя эти изменения кажутся незначительными (фактически, Ψ может образовывать пары оснований с аденозином так же, как это делает уридин), Ψ может относительно значительно изменить структуру РНК, в основном за счет улучшения спаривания оснований, укладки оснований и внесения вклада в создание большей основы. жесткая (через сеть взаимодействий водородных связей) ( Davis, 1995 ; Charette and Gray, 2000 ; Newby and Greenbaum, 2001 , 2002a , 2002b ). Таким образом, псевдоуридилирование РНК обычно стабилизирует РНК. Таким образом, неудивительно, что присутствие этой модификации РНК придает РНК различные биофизические и биохимические свойства. Например, Ψ благоприятствует конформации C3′-эндо в РНК ( Kierzek et al., 2014 ;Вестхоф, 2019 ). Кроме того, кажется, что Ψ увеличивает защиту РНК от нуклеаз. Исследование Naylor et al. показали, что Ψ-содержащие динуклеотиды более устойчивы к деградации змеиным ядом и фосфодиэстеразами селезенки, чем U-содержащие аналоги ( Naylor et al., 1965 ).
Это приводит к тому, что мРНК сохраняется в организме в течение длительного периода времени.
Эндогенная обратная транскрипция.
Общей темой среди проверяющих фактов является то, что вакцины не мешают ДНК реципиентов. Генетический материал в вакцинах просто производит белок, а затем безвредно разлагается, настаивают они. Поэтому, по их мнению, эти вакцины не являются генной терапией.
Reuters — Вакцины Fact Check-mRNA отличаются от генной терапии, которая изменяет гены реципиента.
Компании Pfizer/BioNTech и Moderna разработали прививки, в которых используется часть генетического кода SARS-CoV-2, коронавируса, вызывающего COVID-19, для стимулирования иммунного ответа у реципиентов ( здесь ). Однако эксперты сообщили Reuters, что это не то же самое, что генная терапия.
«Поскольку мРНК является генетическим материалом, мРНК-вакцины можно рассматривать как терапию, основанную на генетике, но они классифицируются как вакцины и не предназначены для изменения ваших генов», — сказал доктор Адам Тейлор, вирусолог и научный сотрудник Menzies Health. Институт, Квинсленд, Университет Гриффита.
Звучит здорово, правда? Но это неправильно.
MDPI – внутриклеточная обратная транскрипция мРНК-вакцины Pfizer BioNTech COVID-19 BNT162b2 in vitro в линии клеток печени человека.
Доклинические исследования мРНК-вакцины COVID-19 BNT162b2, разработанной Pfizer и BioNTech, показали обратимые эффекты на печень у животных, которым вводили инъекцию BNT162b2. Кроме того, недавнее исследование показало, что РНК SARS-CoV-2 может быть подвергнута обратной транскрипции и интегрирована в геном клеток человека. В этом исследовании мы исследовали влияние BNT162b2 на линию клеток печени человека Huh7 in vitro. Клетки Huh7 подвергали воздействию BNT162b2 и проводили количественную ПЦР на РНК, выделенной из клеток. Мы обнаружили высокие уровни BNT162b2 в клетках Huh7 и изменения в экспрессии гена длинного вкрапленного ядерного элемента-1 (LINE-1), который является эндогенной обратной транскриптазой. Иммуногистохимия с использованием связывания антител с РНК-связывающим белком (ORFp1) с открытой рамкой считывания 1 LINE-1 на клетках Huh7, обработанных BNT162b2, показала повышенное распределение ядра LINE-1. ПЦР на геномной ДНК клеток Huh7, подвергнутых воздействию BNT162b2, амплифицирует последовательность ДНК, уникальную для BNT162b2. Наши результаты указывают на быстрое поглощение BNT162b2 линией клеток печени человека Huh7, что приводит к изменениям в экспрессии и распределении LINE-1. Мы также показываем, что мРНК BNT162b2 обратно транскрибируется внутриклеточно в ДНК уже через 6 часов после воздействия BNT162b2.
Опять же, как я уже говорил в предыдущих статьях, синтез белка, один из самых основных процессов жизни, происходит следующим образом: ДНК производит РНК, создает белки. Это действительно настолько просто. Нити ДНК — это постоянные, долгосрочные схемы хранения, которые копируются в РНК, рабочую форму гена, а нити РНК покидают ядро и транслируются в белки рибосомами, которые считывают их и строят белок на одну аминокислоту. время с использованием кодонов в цепи РНК в качестве матрицы. Клетки решают, сколько данного белка производить, увеличивая или уменьшая экспрессию генов.
Ретровирусы, такие как ВИЧ, используют обратную транскриптазу, чтобы превратить свои геномы в ДНК и интегрировать эту ДНК в геном клеток-хозяев, заставляя их постоянно производить белки и вирионы ВИЧ. Вот почему ВИЧ никогда не исчезает. Код для создания большего количества вирионов ВИЧ становится постоянной частью клеток-хозяев.
Итак, SARS-CoV-2 не имеет обратной транскриптазы и не является ретровирусом, а вакцина не содержит обратной транскриптазы. Так что дает? Зачем ему интегрироваться в геном?
Что ж, оказывается, в клетках человека на самом деле есть собственная эндогенная обратная транскриптаза, которой обладают ретротранспозоны LINE-1:
Границы — обратная транскриптаза, кодируемая ретротранспозонами LINE-1 в генезе, прогрессировании и терапии рака.
В геномах высших эукариот ретротранспозоны Long Interspersed Nuclear Element 1 (LINE-1) представляют большое семейство повторяющихся геномных элементов. Они транспонируют с помощью обратной транскриптазы (RT), которую они кодируют как часть продукта ORF2p. Ингибирование RT в раковых клетках либо за счет зависимого от РНК-интерференции молчания активных элементов LINE-1, либо с помощью препаратов, ингибирующих RT, снижает пролиферацию раковых клеток, способствует их дифференцировке и противодействует прогрессированию опухоли на животных моделях. Действительно, ненуклеозидный ингибитор RT эфавиренц недавно был протестирован в ходе фазы II клинических испытаний у пациентов с метастатическим раком предстательной железы. Углубленный анализ ORF2p в мышиной модели рака молочной железы показал, что ORF2p преждевременно экспрессируется в предраковых поражениях и очень распространена на поздних стадиях рака. в то время как он едва обнаруживается в нормальной ткани молочной железы, что обосновывает вывод о том, что опухоли, экспрессирующие RT, терапевтически чувствительны к ингибиторам RT. Мы суммируем механистические исследования и исследования профилирования генов, показывающие, что обильные ОТ, происходящие от LINE-1, могут «изолировать» РНК-субстраты для обратной транскрипции в опухолевых клетках, что влечет за собой образование гибридных молекул РНК: ДНК и нарушение общего производства регуляторных миРНК с глобальным воздействие на клеточный транскриптом. Основываясь на этих данных, ОТ, кодируемая LINE-1-ORF2, обладает потенциалом, способствующим развитию опухоли, который проявляется на эпигенетическом уровне. Мы предлагаем модель, согласно которой LINE1-RT управляет ранее неизвестным глобальным регуляторным процессом, дерегуляция которого приводит к трансформации клеток и онкогенезу с возможными последствиями для гетерогенности раковых клеток. обосновывая вывод о том, что опухоли, экспрессирующие RT, терапевтически чувствительны к ингибиторам RT. Мы суммируем механистические исследования и исследования профилирования генов, показывающие, что обильные ОТ, происходящие от LINE-1, могут «изолировать» РНК-субстраты для обратной транскрипции в опухолевых клетках, что влечет за собой образование гибридных молекул РНК: ДНК и нарушение общего производства регуляторных миРНК с глобальным воздействие на клеточный транскриптом. Основываясь на этих данных, ОТ, кодируемая LINE-1-ORF2, обладает потенциалом, способствующим развитию опухоли, который проявляется на эпигенетическом уровне. Мы предлагаем модель, согласно которой LINE1-RT управляет ранее неизвестным глобальным регуляторным процессом, дерегуляция которого приводит к трансформации клеток и онкогенезу с возможными последствиями для гетерогенности раковых клеток. обосновывая вывод о том, что опухоли, экспрессирующие RT, терапевтически чувствительны к ингибиторам RT. Мы суммируем механистические исследования и исследования профилирования генов, показывающие, что обильные ОТ, происходящие от LINE-1, могут «изолировать» РНК-субстраты для обратной транскрипции в опухолевых клетках, что влечет за собой образование гибридных молекул РНК: ДНК и нарушение общего производства регуляторных миРНК с глобальным воздействие на клеточный транскриптом. Основываясь на этих данных, ОТ, кодируемая LINE-1-ORF2, обладает потенциалом, способствующим развитию опухоли, который проявляется на эпигенетическом уровне. Мы предлагаем модель, согласно которой LINE1-RT управляет ранее неизвестным глобальным регуляторным процессом, дерегуляция которого приводит к трансформации клеток и онкогенезу с возможными последствиями для гетерогенности раковых клеток.
Упс. Теперь ген вакцины является частью генома реципиента. Это означает, что это генная терапия. Если область генома, в которую он включен, не молчит и действительно экспрессирует белок, эта клетка теперь начнет производить этот белок на неопределенный срок.
За исключением того, что здесь есть небольшая проблема. Этот ген кодирует шип SARS-CoV-2. Высокотоксичный белок.
Инокуляция шипа SARS-CoV-2 как токсическая протеинопатия.
Спайк SARS-CoV-2 имеет на своей поверхности множество мотивов весьма сомнительного характера.
Агенты J Biol Regul Homeost — помните о шиповидном белке SARS-CoV-2: это больше, чем кажется на первый взгляд.
пЛандемия COVID-19 потребовала быстрого производства вакцин, направленных на выработку нейтрализующих антител против спайкового белка COVID-19, необходимых для связывания вируса короны с клетками-мишенями. В наиболее известных вакцинах используется либо мРНК, либо аденовирусный вектор, чтобы заставить клетки человека вырабатывать шиповидный белок, против которого организм вырабатывает в основном нейтрализующие антитела. Однако недавние сообщения вызвали некоторый скептицизм в отношении биологического действия шиповидного белка и типов продуцируемых антител. В одной статье сообщалось, что определенные антитела в крови инфицированных пациентов, по-видимому, изменяют форму шиповидного белка, повышая вероятность его связывания с клетками. в то время как другие работы показали, что спайковый белок сам по себе (не будучи частью вируса короны) может повреждать эндотелиальные клетки и нарушать гематоэнцефалический барьер. Эти результаты могут быть даже более актуальными для патогенеза синдрома длительного COVID, который может затронуть до 50% инфицированных SARS-CoV-2. При COVID-19 в ответ на окислительный стресс требуется увеличение количества антиоксидантных ферментов. В связи с этим известно, что полифенолы являются природными антиоксидантами, оказывающими множественное воздействие на здоровье. Следовательно, есть еще больше причин для вмешательства с использованием антиоксидантных соединений, таких как лютеолин, в дополнение к доступным вакцинам и противовоспалительным препаратам для предотвращения вредного действия шиповидного белка. Эти результаты могут быть даже более актуальными для патогенеза синдрома длительного COVID, который может затронуть до 50% инфицированных SARS-CoV-2. При COVID-19 в ответ на окислительный стресс требуется увеличение количества антиоксидантных ферментов. В связи с этим известно, что полифенолы являются природными антиоксидантами, оказывающими множественное воздействие на здоровье. Следовательно, есть еще больше причин для вмешательства с использованием антиоксидантных соединений, таких как лютеолин, в дополнение к доступным вакцинам и противовоспалительным препаратам для предотвращения вредного действия шиповидного белка. Эти результаты могут быть даже более актуальными для патогенеза синдрома длительного COVID, который может затронуть до 50% инфицированных SARS-CoV-2. При COVID-19 в ответ на окислительный стресс требуется увеличение количества антиоксидантных ферментов. В связи с этим известно, что полифенолы являются природными антиоксидантами, оказывающими множественное воздействие на здоровье. Следовательно, есть еще больше причин для вмешательства с использованием антиоксидантных соединений, таких как лютеолин, в дополнение к доступным вакцинам и противовоспалительным препаратам для предотвращения вредного действия шиповидного белка.
MDPI — биологические и клинические последствия связывания интегрина с помощью мошеннического мотива RGD в шиповидном белке SARS CoV-2.
Хотя ACE2 (ангиотензинпревращающий фермент 2) считается основным рецептором для проникновения в клетки CoV-2, недавние отчеты предполагают, что могут способствовать альтернативные пути. В этой статье рассматривается гипотеза о том, что связывание вируса с интегринами клеточной поверхности может способствовать высокой инфекционности и широкому внелегочному воздействию вируса SARS-CoV-2. Этот потенциал предполагается на основании появления последовательности RGD (аргинин-глицин-аспартат) в рецептор-связывающем домене шиповидного белка. RGD представляет собой мотив, обычно используемый вирусами для связывания интегринов клеточной поверхности. Многочисленные сигнальные пути опосредованы интегринами, и связывание вирионов может привести к нарушению регуляции этих путей с последующим повреждением тканей. Интегрины на поверхности пневмоцитов, эндотелиальных клеток и тромбоцитов могут быть уязвимы для связывания вириона CoV-2. Например, связывание интактных вирионов с интегринами на альвеолярных клетках может усиливать проникновение вируса. Связывание вирионов с интегринами на эндотелиальных клетках может активировать ангиогенные сигнальные пути клеток; нарушение регуляции интегрин-опосредованных сигнальных путей, контролирующих процессы развития; и ускоряют активацию эндотелия, чтобы инициировать свертывание крови. Такое прокоагулянтное состояние, возможно, вместе с усилением агрегации тромбоцитов за счет вирионов, связывающихся с интегринами на тромбоцитах, может усиливать продукцию микротромбов, которые представляют угрозу легочного тромбоза и эмболии, инсультов и других тромботических последствий. Восприимчивость различных тканей к взаимодействиям вириона и интегрина может модулироваться множеством факторов, включая конформацию соответствующих интегринов и влияние тканевого микроокружения на конформацию шиповидных белков. Специфические для пациентов различия этих факторов могут способствовать высокой вариабельности клинических проявлений. Существует опасность того, что появление мутаций рецептор-связывающего домена, повышающих инфекционность, может также усилить доступ мотива RGD для связывания интегрина, что приведет к появлению вирусных штаммов с независимыми от ACE2 путями проникновения в клетку и новыми биологическими и клиническими воздействиями, опосредованными интегрином. Высокоинфекционный вариант, B.1.1.7 (или VUI 202012/01), включает аминокислотную замену рецептор-связывающего домена, N501Y, которая потенциально может обеспечить мотив RGD с расширенным доступом к интегринам клеточной поверхности с последующими клиническими последствиями. . Специфические для пациентов различия этих факторов могут способствовать высокой вариабельности клинических проявлений. Существует опасность того, что появление мутаций рецептор-связывающего домена, повышающих инфекционность, может также усилить доступ мотива RGD для связывания интегрина, что приведет к появлению вирусных штаммов с независимыми от ACE2 путями проникновения в клетку и новыми биологическими и клиническими воздействиями, опосредованными интегрином. Высокоинфекционный вариант, B.1.1.7 (или VUI 202012/01), включает аминокислотную замену рецептор-связывающего домена, N501Y, которая потенциально может обеспечить мотив RGD с расширенным доступом к интегринам клеточной поверхности с последующими клиническими последствиями. . Специфические для пациентов различия этих факторов могут способствовать высокой вариабельности клинических проявлений. Существует опасность того, что появление мутаций рецептор-связывающего домена, повышающих инфекционность, может также усилить доступ мотива RGD для связывания интегрина, что приведет к появлению вирусных штаммов с независимыми от ACE2 путями проникновения в клетку и новыми биологическими и клиническими воздействиями, опосредованными интегрином. Высокоинфекционный вариант, B.1.1.7 (или VUI 202012/01), включает аминокислотную замену рецептор-связывающего домена, N501Y, которая потенциально может обеспечить мотив RGD с расширенным доступом к интегринам клеточной поверхности с последующими клиническими последствиями. . Существует опасность того, что появление мутаций рецептор-связывающего домена, повышающих инфекционность, может также усилить доступ мотива RGD для связывания интегрина, что приведет к появлению вирусных штаммов с независимыми от ACE2 путями проникновения в клетку и новыми биологическими и клиническими воздействиями, опосредованными интегрином. Высокоинфекционный вариант, B.1.1.7 (или VUI 202012/01), включает аминокислотную замену рецептор-связывающего домена, N501Y, которая потенциально может обеспечить мотив RGD с расширенным доступом к интегринам клеточной поверхности с последующими клиническими последствиями. . Существует опасность того, что появление мутаций рецептор-связывающего домена, повышающих инфекционность, может также усилить доступ мотива RGD для связывания интегрина, что приведет к появлению вирусных штаммов с независимыми от ACE2 путями проникновения в клетку и новыми биологическими и клиническими воздействиями, опосредованными интегрином. Высокоинфекционный вариант, B.1.1.7 (или VUI 202012/01), включает аминокислотную замену рецептор-связывающего домена, N501Y, которая потенциально может обеспечить мотив RGD с расширенным доступом к интегринам клеточной поверхности с последующими клиническими последствиями. .
Elsevier – Взаимодействие шиповидных белков SARS-CoV-2 с амилоидогенными белками: потенциальные ключи к нейродегенерации.
Постинфекция COVID-19 включает множество неврологических симптомов, включая нейродегенерацию. Агрегацию белков в головном мозге можно рассматривать как одну из важных причин нейродегенерации. Домен, связывающий белковый рецептор SARS-CoV-2 Spike S1 (SARS-CoV-2 S1 RBD), связывается с гепарином и связывающими гепарин белками. Более того, связывание гепарина ускоряет агрегацию патологических амилоидных белков, присутствующих в головном мозге. В этой статье мы показали, что RBD SARS-CoV-2 S1 связывается с рядом склонных к агрегации белков, связывающих гепарин, включая Aβ, α-синуклеин, тау, прион и TDP-43 RRM. Эти взаимодействия предполагают, что сайт связывания гепарина на белке S1 может способствовать связыванию амилоидных белков с поверхностью вируса и, таким образом, может инициировать агрегацию этих белков и, в конечном итоге, вести к нейродегенерации в головном мозге. Результаты помогут нам предотвратить будущие последствия нейродегенерации, нацелившись на этот процесс связывания и агрегации.
bioRxiv (препринт) — SARS-CoV-2 вызывает воспаление головного мозга и индуцирует образование телец Леви у макак.
SARS-CoV-2 может вызывать острые респираторные заболевания, но инфекция также может вызывать неврологические симптомы. Здесь мы показываем, что инфекция SARS-CoV-2 вызывает воспаление головного мозга на модели макаки. Повышенная метаболическая активность в гипофизе двух макак наблюдалась с помощью продольной позитронно-эмиссионной томографии-компьютерной томографии (ПЭТ-КТ). Посмертный анализ показал инфильтрацию Т-клеток и активированной микроглии в головном мозге, а вирусную РНК обнаружили в тканях головного мозга одного животного. Мы наблюдали тельца Леви в головном мозге всех макак-резусов. Эти данные подчеркивают способность вируса вызывать невропатологию в этой модели инфекции SARS-CoV-2 на приматах. Как и у людей, образование телец Леви является признаком развития болезни Паркинсона.
Nature Neuroscience — белок S1 вируса SARS-CoV-2 проникает через гематоэнцефалический барьер у мышей.
Неясно, может ли коронавирус тяжелого острого респираторного синдрома 2, вызывающий коронавирусную болезнь 2019 года, проникнуть в мозг. Коронавирус 2 тяжелого острого респираторного синдрома связывается с клетками через субъединицу S1 своего шиповидного белка. Мы показываем, что внутривенно введенный радиоактивный йод S1 (I-S1) легко преодолевал гематоэнцефалический барьер у самцов мышей, поглощался областями мозга и проникал в паренхиматозное пространство головного мозга. I-S1 также поглощался легкими, селезенкой, почками и печенью. I-S1, введенный интраназально, также проникал в мозг, хотя на уровне примерно в десять раз ниже, чем после внутривенного введения. АПОЕгенотип и пол не влияли на поглощение I-S1 всем мозгом, но оказывали различное влияние на поглощение обонятельной луковицей, печенью, селезенкой и почками. Поглощение I-S1 в гиппокампе и обонятельной луковице было снижено из-за липополисахарид-индуцированного воспаления. Механистические исследования показали, что I-S1 преодолевает гематоэнцефалический барьер путем адсорбционного трансцитоза и что мышиный ангиотензинпревращающий фермент 2 участвует в поглощении мозгом и легкими, но не в поглощении почками, печенью или селезенкой.
Субъединица S1 шипа SARS-CoV-2 может преодолевать гематоэнцефалический барьер и индуцировать образование телец Леви. Если она может сделать это с кем-то, кто инфицирован, то остается открытым вопрос, может ли вакцина, которая вырабатывает этот белок в организме, сделать то же самое. У него есть не только область связывания ACE2; он также имеет области, связывающие интегрин и гепарин, которые могут быть экспонированы даже в спайках, заблокированных до слияния.
На самом деле шип SARS-CoV-2 проникает в ГЭБ:
Спрингер — шиповидный белок SARS-CoV-2 нарушает целостность гематоэнцефалического барьера посредством активации RhoA.
Анализы ELISA показали, что шиповидный белок S1 значительно увеличивал активацию RhoA, демонстрируя, что малая ГТФаза влияет на разрушение барьера в ответ на SARS-CoV-2. Было показано, что активация RhoA индуцирует сократимость клеток и реструктуризацию цитоскелета, приводя к повышенной подвижности клеток и нарушению целостности барьера (Shaw et al. 1998 ; Mikelis et al. 2015 ). Этот вывод подтверждается тестами проницаемости и TEER, показывающими, что пагубные эффекты спайкового белка S1 на ГЭБ устраняются путем ингибирования активации RhoA (рис. 3 ). Учитывая, что RhoA активирует киназу Rho (ROCK), следует отметить, что терапевтические эффекты ингибирования ROCK уже рассматривались для лечения тяжелой формы COVID-19 (Abedi et al.2020б ). Фактически, доклинические исследования показали преимущества ингибирования пути Rho-ROCK для улучшения легочных исходов (Xu et al. 2019 ; Abedi et al. 2020a ). Кроме того, было показано, что ингибиторы ROCK защищают легочную ткань при тяжелых респираторных заболеваниях (Abedi et al. 2020a , b ). Эффекты ингибирования ROCK, по-видимому, также обеспечивают защиту сосудов, демонстрируя улучшение неврологических исходов после ишемического инсульта (Shibuya et al. 2005 ). Возможно, аналогичный терапевтический подход можно было бы разработать для предотвращения неврологического дефицита, связанного с COVID-19.
Но подожди , говоришь! Не заперт ли этот белок на клеточной поверхности трансмембранным доменом? Да, в теории. За исключением того, что шип SARS-CoV-2 состоит из разных частей; субъединицы S1 и S2. Протеазы человека, такие как TMPRSS2, могут отщеплять S1 от S2, в результате чего S1 уплывает во внеклеточное пространство и, возможно, даже попадает в кровоток. Оттуда он может пересечь гематоэнцефалический барьер, а затем вызвать амилоидогенные эффекты в головном мозге. Это всего лишь один из возможных механизмов травмы. Есть и другие.
Спайк SARS-CoV-2 имеет суперантигенную область, также известную как SAg.
PNAS — суперантигенный характер вставки, уникальной для спайка SARS-CoV-2, поддерживаемой асимметричным репертуаром TCR у пациентов с гипервоспалением.
Связывающий эпитоп на S содержит мотив последовательности, уникальный для SARS-CoV-2 (отсутствующий в других коронавирусах, связанных с SARS), который очень похож как по последовательности, так и по структуре на бактериальный суперантиген стафилококковый энтеротоксин B. Это взаимодействие между вирусом и человеческие Т-клетки могут быть усилены редкой мутацией (D839Y/N/E) европейского штамма SARS-CoV-2. Кроме того, межфазная область включает выбранные остатки из мотива, подобного межклеточной молекуле адгезии (ICAM), общего для вирусов SARS во время пандемий 2003 и 2019 годов. Мотив нейротоксиноподобной последовательности в рецептор-связывающем домене также проявляет высокую тенденцию к связыванию TCR. Анализ репертуара TCR у взрослых пациентов с COVID-19 показывает, что у пациентов с тяжелым гипервоспалительным заболеванием наблюдается перекос TCR, соответствующий активации суперантигена.
Антитела против спайков могут вести себя как аутоантитела и атаковать здоровые ткани:
ResearchSquare (препринт) — Патогенные антитела, индуцированные шиповидными белками вирусов COVID-19 и SARS-CoV.
В совокупности результаты анализа in vitro показали, что определенные антитела, специфичные к шиповидным белкам вирусов COVID-19 и SARS-CoV, могут ввести иммунную систему в заблуждение, чтобы она атаковала хозяина, связываясь с больными клетками, такими как клетки легких человека. клеток эпителия in vivo. Мы назвали этот механизм действия антител «антителозависимой аутоатакой» (ADAA).
Сам шип способен запускать все виды потенциально вредной внутриклеточной активности, действуя как лиганд для различных типов рецепторов:
MDPI — Спайковый белок SARS-CoV-2 вызывает клеточную передачу сигналов в клетках человека-хозяина: значение для возможных последствий вакцин против COVID-19.
Мир страдает от пандемии коронавирусной болезни 2019 года (COVID-19), вызванной коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2). SARS-CoV-2 использует свой шиповидный белок для проникновения в клетки-хозяева. В настоящее время разрабатываются вакцины, которые вводят шиповидный белок в наш организм для выявления антител, нейтрализующих вирус. В этой статье мы отмечаем, что клетки человека-хозяина чувствительно реагируют на шиповидный белок, чтобы вызвать клеточную передачу сигналов. Таким образом, важно знать, что шиповидный белок, продуцируемый новыми вакцинами против COVID-19, может также воздействовать на клетки-хозяева. Мы должны внимательно следить за долгосрочными последствиями этих вакцин, особенно когда они вводятся здоровым людям.
Наконец, что самое ужасное, было обнаружено, что спайки SARS-CoV-2 локализуются в ядрах клеток и ингибируют рекомбинацию V(D)J:
MDPI – спайк SARS-CoV-2 нарушает репарацию повреждений ДНК и ингибирует рекомбинацию V(D)J in vitro.
Тяжелый острый респираторный синдром коронавирус 2 (SARS-CoV-2) привел к пандемии коронавирусной болезни 2019 (COVID-19), которая серьезно повлияла на здоровье населения и мировую экономику. Адаптивный иммунитет играет решающую роль в борьбе с инфекцией SARS-CoV-2 и напрямую влияет на клинические исходы пациентов. Клинические исследования показали, что у пациентов с тяжелой формой COVID-19 проявляются отсроченные и слабые адаптивные иммунные реакции; однако механизм, с помощью которого SARS-CoV-2 препятствует адаптивному иммунитету, остается неясным. Здесь, используя клеточную линию in vitro, мы сообщаем, что шиповидный белок SARS-CoV-2 значительно ингибирует репарацию повреждений ДНК, что необходимо для эффективной рекомбинации V(D)J в адаптивном иммунитете. Механически, мы обнаружили, что шиповидный белок локализуется в ядре и ингибирует репарацию повреждений ДНК, препятствуя рекрутированию ключевых белков репарации ДНК BRCA1 и 53BP1 в место повреждения. Наши результаты раскрывают потенциальный молекулярный механизм, с помощью которого белок шипа может препятствовать адаптивному иммунитету, и подчеркивают потенциальные побочные эффекты полноразмерных вакцин на основе шипа.
Рекомбинация V(D)J является не только одним из многих процессов, жизненно важных для репарации ДНК, она также необходима для образования Т- и В-лимфоцитов, где рекомбинация используется для создания лимфоцитов, специализированных для определенных патогенов.
Биология PLOS — рекомбинация V (D) J и эволюция адаптивной иммунной системы.
Иммунная система должна быть в состоянии идентифицировать и в конечном итоге уничтожить чужеродных захватчиков. Для этого он использует два основных типа иммунных клеток, Т-клетки и В-клетки (или, вместе взятые, лимфоциты). Лимфоциты обладают большим разнообразием рецепторов клеточной поверхности, которые могут распознавать неограниченное количество патогенов и реагировать на них, что является отличительной чертой «адаптивной» иммунной системы. Чтобы реагировать на такое разнообразие захватчиков, иммунной системе необходимо генерировать огромное количество рецепторов. Если бы количество различных типов рецепторов, присутствующих на лимфоцитах, кодировалось отдельными генами, весь геном человека должен был бы быть посвящен рецепторам лимфоцитов. Чтобы установить необходимый уровень разнообразия, гены рецепторов В- и Т-клеток (BCR и TCR соответственно) создаются путем рекомбинации ранее существовавших генных сегментов. Таким образом, различные комбинации конечного набора генных сегментов дают начало рецепторам, способным распознавать неограниченное количество чужеродных захватчиков. Это достигается за счет в высшей степени хорошо скоординированного набора реакций, начиная с расщепления ДНК в пределах специфических, хорошо консервативных рекомбинационных сигнальных последовательностей (RSS). Этот строго регулируемый этап осуществляется специфическими для лимфоцитов генами, активирующими рекомбинацию (RAG1 и RAG2 ). Затем сегменты повторно собираются с использованием общего механизма клеточной репарации.
Ингибирование рекрутирования BRCA1 и 53BP1 в целом будет иметь эффект, аналогичный эффекту дефицита RAG при синдроме Оменна. Это приведет к лимфопении и иммунодефициту.
Помните, что один скромный хиропрактик Натан Томпсон сказал в прошлом году об анализах крови привитых людей?
д-р НАТАН ТОМПСОН ПРОВЕРЯЕТ ИММУННУЮ СИСТЕМУ ПАЦИЕНТА ПОСЛЕ КАЖДОГО УКОЛА.
Децимированные лимфоциты, в том числе естественные киллеры (НК), не только сделают человека более восприимчивым ко всем вирусным, бактериальным, грибковым или паразитарным инфекциям, но и повысят шансы заболеть раком.
Фактчекеры Reuters, отвечая на многочисленные сообщения в социальных сетях о «VAIDS», заявили, что вакцина не может вызвать иммунодефицит.
Reuters – Проверка фактов. Эксперты говорят, что СПИД – это не настоящий синдром, вызванный вакциной; нет доказательств того, что вакцины против COVID-19 вызывают иммунодефицит.
Утверждения о том, что есть случаи СПИДа, вызванного вакцинацией, или «VAIDS», как утверждают интернет-пользователи, однако, необоснованны.
«Я не знаю такого явления, как «синдром вакциноиндуцированного иммунодефицита». Это не настоящий синдром», — сообщила Рейтер по электронной почте Донна Фарбер, заведующая отделением хирургических наук и профессор микробиологии и иммунологии Колумбийского университета.
Точно так же Стивен Глюкман, доктор медицинских наук, профессор инфекционных заболеваний в Медицинской школе Перельмана в Пенсильванском университете и медицинский директор Penn Global Medicine, сказал Рейтер, что «VAIDS» — это «абсолютно не» реальное заболевание.
И все же есть файлы, в которых описывается, как Spike может предотвратить образование Т- и В-лимфоцитов, отсекая их прямо у источника.
Это полная противоположность тому, что вы хотите от вакцины. Смысл вакцины, опять же, в том, чтобы тренировать адаптивную иммунную систему, а не саботировать ее.
Токсичность компонентов вакцины.
Как оказалось, псевдоуридилирование мРНК вакцины может не только ускользать от толл-подобных рецепторов (TLR), но и фактически подавлять всю их активность. Это плохо, потому что TLR необходимы для обнаружения сигналов опасности, связанных с инфекцией и раком.
medRXiv (препринт) — мРНК-вакцина BNT162b2 против SARS-CoV-2 перепрограммирует как адаптивный, так и врожденный иммунный ответ.
Вакцина BNT162b2 на основе мРНК от Pfizer/BioNTech была первой зарегистрированной вакциной против COVID-19, и было показано, что она до 95% эффективна в предотвращении инфекций SARS-CoV-2. Мало что известно о широких эффектах нового класса мРНК-вакцин, особенно о том, оказывают ли они комбинированное воздействие на врожденный и адаптивный иммунные ответы. Здесь мы подтвердили, что вакцинация здоровых людей BNT162b2 индуцировала эффективный гуморальный и клеточный иммунитет против нескольких вариантов SARS-CoV-2. Интересно, однако, что вакцина BNT162b2 также модулировала выработку воспалительных цитокинов клетками врожденного иммунитета при стимуляции как специфическими (SARS-CoV-2), так и неспецифическими (вирусными, грибковыми и бактериальными) стимулами. Ответ клеток врожденного иммунитета на лиганды TLR4 и TLR7/8 был ниже после вакцинации BNT162b2, в то время как индуцированные грибами ответы цитокинов были сильнее. В заключение, мРНК-вакцина BNT162b2 вызывает сложное функциональное перепрограммирование врожденных иммунных ответов, что следует учитывать при разработке и использовании этого нового класса вакцин.
Липидные наночастицы, используемые в вакцинах Pfizer и Moderna, могут вызывать редкие аллергические реакции:
Молекулярная терапия – аллергические реакции и анафилаксия на вакцины против COVID-19 на основе LNP.
Смертность от коронавирусной болезни 2019 (COVID-19) среди групп высокого риска, таких как пожилые люди, некоторые этнические группы (например, чернокожие/афроамериканцы и латиноамериканцы/латиноамериканцы), лица с ожирением и лица с эндотелиальной дисфункцией, значительна. Хотя варианты лечения ограничены, вакцинация против SARS-CoV-2, вируса, вызывающего COVID-19, является наиболее важной глобальной стратегией борьбы с пандемией. Так, две мРНК-вакцины на основе липидных наночастиц (LNP) (Pfizer-BioNTech и Moderna) против SARS-CoV-2 уже получили разрешение на экстренное использование от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). В период с 14 по 23 декабря 2020 г. после введения 1 893 360 первых доз вакцины Pfizer-BioNTech против COVID-19 в Систему отчетности о побочных эффектах вакцин (VAERS) было зарегистрировано 175 случаев тяжелой аллергической реакции.
Он не остается в дельтовидной мышце.
Эти вакцины распространяются по всему телу и биоаккумулируются в органах. Это было доказано японским исследованием биораспределения вакцины Pfizer. Отчет Pfizer можно просмотреть в защищенной от цензуры форме 404 в Brave или через шлюз IPFS, используя следующий CID:
ipfs://Qmd7DB3AsyVkwzzDkWz9xYQEG3zFLXfpGRdXYnRkCbt26j
Это исследование показало, что вакцина Pfizer-BioNTech BNT162B2 не только не остается в плече, но и биоаккумулируется повсюду, особенно в половых железах.
Непреднамеренная внутривенная инъекция мРНК-вакцины COVID-19 из-за невозможности аспирации иглы может иметь серьезные последствия:
Клинические инфекционные заболевания – внутривенная инъекция мРНК-вакцины против коронавирусной болезни 2019 (COVID-19) может вызвать острый миоперикардит на мышиной модели
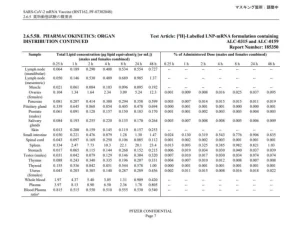
Группам самок мышей Balb/c в возрасте 6–8 недель вводили мРНК-вакцину BNT162b2 COVID-19 либо внутривенно, либо внутримышечно, либо в том же объеме NS (). Ни у одного из животных не было клинических признаков вялости, взъерошенной шерсти, сгорбленной позы и учащенного дыхания на протяжении всего периода наблюдения. Значительное снижение массы тела наблюдалось в группе с внутримышечной вакциной мРНК (в среднем 3,6% ± 2,1%), начиная с 1 dpi; животные восстанавливали свой первоначальный вес на 7 dpi (). Вскрытие при 1-2 днях на дюйм показало белые пятна на висцеральном перикарде у 37,5% (1 день на дюйм, n = 8) до 38,5% (2 дня на дюйм, n = 13) в группе внутривенной вакцины, но ни в одной контрольной группе, получавшей внутримышечную вакцину или NS. (и ; ; P < 0,05). В других органах животных не наблюдалось никаких заметных изменений ( дополнительная фигура 1 ).
Показательны графические изображения вскрытых мышей в этой статье, показывающие белые пятна на сердце. Что еще более трагично, так это то, что этого можно было бы избежать, просто оттянув поршень шприца после введения, чтобы убедиться, что техник не задел кровеносный сосуд.
Миокардит, вызванный вакциной COVID-19, является результатом токсичной вакцины в сочетании с плохой подготовкой, граничащей с медицинской халатностью.
Миокардит не легкий. Сердечная ткань плохо регенерирует после превращения в рубцовую ткань. Ожидаемая продолжительность жизни после тяжелого случая миокардита измеряется однозначной цифрой лет. Во многих случаях для разрешения требуется трансплантация сердца.
Нет, это не ваше воображение. Да, футболисты падают и умирают от сердечной недостаточности.
Pfizer заставили кашлять.
Недавно Pfizer по решению суда потребовали обнародовать несколько крайне разоблачающих документов, включая этот:
Этот документ также можно просмотреть в защищенной от цензуры форме с 404-проверкой, используя этот IPFS CID:
ipfs://QmPDNfStzBca3itUn2HX4BeqQPYnivSJ672djz3eLr3gG2
В этом документе сообщается о десятках тысяч побочных эффектов и 1223 летальных исходах у субъектов, принимавших вакцину. Конечно, в сообщениях VAERS вакцина не является единственной причиной; многие люди, умершие после введения вакцины, умерли не по причинам, связанным с вакциной. Однако это уравновешивается занижением отчетности; Считается, что система VAERS зафиксировала менее десятой части всех нежелательных явлений.
Короче говоря, исходя из этих данных, вполне возможно, что вакцина Pfizer уже убила тысячи людей. Кто знает, сколько еще будет страдать и умирать от долгосрочных последствий этих вакцин? Эта вакцина повреждает миокард и перикард, а шип SARS-CoV-2 ингибирует репарацию ДНК и способствует образованию амилоидных бляшек. Ожидаем ли мы повышенный уровень сердечно-сосудистых заболеваний, рака и нейродегенерации в течение следующих десяти лет среди миллиардов людей, которым уже сделали прививку? Никто не знает наверняка.
Поскольку это постоянное событие, с каждым днем появляется все больше данных и публикуется все больше документов.
Антитело-зависимое усиление.
Существует еще один механизм, из-за которого вакцины могут не сработать, и он известен как ADE, или антителозависимое усиление болезни. Известно, что это происходит при лихорадке Денге. Если кто-то заражен одним штаммом денге, а затем выздоравливает и заражается другим штаммом, его собственные антитела могут сделать его очень больным. Это происходит из-за того, что называется первородным антигенным грехом. Антитела одного серотипа Денге несовместимы с другими серотипами. Они не полностью нейтрализуют патоген, позволяя вирусу инфицировать макрофаги через путь Fc.
Отказ вакцины из-за ADE имеет прецедент в новейшей истории. Считается, что это причина провала Dengvaxia от Sanofi.
CIDRAP – Санофи ограничивает вакцину против лихорадки денге, но преуменьшает значение усиления антител.
Первые исследователи денге Скотт Холстед, доктор медицинских наук, и Филип К. Рассел, доктор медицинских наук, предсказали это движение почти 2 года назад. Они видели результаты испытаний Dengvaxia, свидетельствующие об антителозависимом усилении (ADE), феномене денге, который делает повторные инфекции более тяжелыми и может вызвать тяжелое заболевание после вакцинации у тех, кто ранее не подвергался воздействию вируса.
Примерно во время вспышки COVID-19 Ши Чжэнли, «леди-летучая мышь» из Уханьского института вирусологии, опубликовала эту статью, заявив, что MERS-CoV способен вызывать ADE:
Журнал вирусологии — Молекулярный механизм антителозависимого усиления проникновения коронавируса.
Чтобы исследовать ADE проникновения коронавируса, мы сначала охарактеризовали взаимодействие между Mersmab1 (который представляет собой RBD-специфическое MAb MERS-CoV) и шипом MERS-CoV с использованием биохимических методов. Сначала был проведен твердофазный иммуноферментный анализ (ИФА) между Mermab1 и RBD MERS-CoV, а также между Mersmab1 и шиповидным эктодоменом (Se) MERS-CoV ( рис. 2A ).). С этой целью Mersmab1 (который был в избытке) использовали для покрытия планшета для ELISA и добавляли градиентные количества рекомбинантного RBD или Se для обнаружения потенциального связывания с Mersmab1. Результаты показали, что и RBD, и Se связывались с Mersmab1. Se связывался с Mersmab1 более тесно, чем RBD, вероятно, из-за поливалентных эффектов, связанных с тримерным состоянием Se. Во-вторых, мы получили Fab из Mersmab1, используя расщепление папаином, и исследовали связывание между Fab и Se с помощью ELISA. Рекомбинантный Se (который был в избытке) использовали для покрытия планшета ELISA, и добавляли градиентные количества Fab или Mersmab1 для обнаружения потенциального связывания с Se. Результаты показали, что и Fab, и Mersmab1 связывались с Se ( рис. 2B ).). Mersmab1 связывается с Se более тесно, чем Fab, также, вероятно, из-за поливалентных эффектов, связанных с димерным состоянием Mersmab1. В-третьих, был проведен анализ проточной цитометрии для обнаружения связывания между Se и рецептором DPP4, а также между Se, Mersmab1 и CD32A (который является рецептором Fc). С этой целью DPP4 или CD32A экспрессировали на поверхности клеток HEK293T человека (клетки почки человека) и добавляли рекомбинантный Se для обнаружения потенциального связывания с одним из двух рецепторов в отсутствие или в присутствии Mersmab1. Результаты показали, что без Mersmab1 Se связывался только с DPP4; в присутствии Mersmab1 Se связывался с CD32A ( фиг. 2C ). В качестве отрицательного контроля использовали MAb, специфичные для RBD SARS-CoV ( 49) не опосредовал связывание Se с CD32A. Экспрессию как DPP4, так и CD32A на клеточной поверхности измеряли и использовали для калибровки результатов проточной цитометрии ( рис. 2D ), демонстрируя, что прямое связывание Se с DPP4 сильнее, чем непрямое связывание Se с CD32A через Mersmab1. В целом, эти биохимические результаты показывают, что Mersmab1 не только напрямую связывается с областью RBD Se БВРС-КоВ, но также опосредует непрямые связывающие взаимодействия между Se БВРС-КоВ и Fc-рецептором.
Однако известно, что ADE не возникает при SARS-CoV-2. С другой стороны, может быть, оно еще не появилось. При дальнейших мутациях антитела к существующим штаммам могут стать ненейтрализующими.
BioRXiv (препринт) — дельта-вариант SARS-CoV-2 готов приобрести полную устойчивость к вакцинам дикого типа.
Вакцины на основе мРНК обеспечивают эффективную защиту от наиболее распространенных вариантов SARS-CoV-2. Однако выявление вероятных прорывных вариантов имеет решающее значение для будущей разработки вакцины. Здесь мы обнаружили, что вариант Delta полностью избегал нейтрализующих антител против N-концевого домена (NTD), при этом повышая чувствительность к антителам, усиливающим инфекционность против NTD. Хотя BNT162b2-иммунные сыворотки Pfizer-BioNTech нейтрализовали дельта-вариант, когда четыре распространенные мутации были введены в рецептор-связывающий домен (RBD) дельта-варианта (Delta 4+), некоторые BNT162b2-иммунные сыворотки теряли нейтрализующую активность и повышали инфекционность. Уникальные мутации в Delta NTD были связаны с повышенной инфекционностью BNT162b2-иммунных сывороток. Сыворотка мышей, иммунизированных дельта-спайком, но не спайком дикого типа, последовательно нейтрализовали вариант Delta 4+ без повышения инфекционности. Учитывая тот факт, что согласно базе данных GISAID уже появился дельта-вариант с тремя похожими мутациями RBD, необходимо разработать вакцины, защищающие от таких полных прорывных вариантов.
Хотя производители вакцин считают, что они достаточно усердны, чтобы не вызывать ADE своими вакцинами против COVID-19, важно помнить, что всплеск в существующих вакцинах основан на уханьском штамме вируса. В лучшем случае это похоже на прививку от гриппа двухлетнему ребенку. В худшем случае это может быть подготовка организма к возникновению ADE в будущем, наряду со всеми другими неблагоприятными последствиями, которые он вызывает.
Эффективность вакцин быстро снижается.
Хотя вакцины предположительно были эффективны против варианта Дельта, их эффективность в предотвращении заражения вариантом Омикрон практически равна нулю.
MedRXiv (препринт) – Эффективность вакцин против COVID-19 против симптоматической инфекции Omicron или Delta и тяжелых исходов.
Мы включили 16 087 Omicron-положительных случаев, 4 261 Delta-положительный случай и 114 087 тестов с отрицательным результатом. ВЭ против симптоматической дельта-инфекции снизилась с 89% (95% ДИ, 86-92%) через 7-59 дней после второй дозы до 80% (95% ДИ, 74-84%) через ≥240 дней, но увеличилась до 97%. (95% ДИ, 96-98%) ≥7 дней после третьей дозы. ВЭ против симптоматической инфекции Омикрон составляла всего 36% (95% ДИ, 24–45%) через 7–59 дней после второй дозы и не обеспечивала защиты через ≥180 дней, но увеличивалась до 61% (95% ДИ, 56–65%). ) ≥7 дней после третьей дозы. VE против тяжелых исходов была очень высокой после третьей дозы как для Delta, так и для Omicron (99% [95% ДИ, 98-99%] и 95% [95% ДИ, 87-98%] соответственно).
Нелепо, чтобы правительства продолжали заставлять людей делать эти вакцины.
Это еще более смешно, если учесть, что вакцины никогда не были такими эффективными.
Заявленные цифры эффективности 95% для вакцины Pfizer и 94% для Moderna основаны на снижении относительного, а не абсолютного риска. Относительное снижение риска — это показатель, который предполагает, что все заражены одновременно. Абсолютное снижение риска включает тех, кто не был инфицирован. Когда рассчитывается ARR вакцин против COVID-19, результат звучит гораздо, гораздо менее впечатляюще.
Ланцет – эффективность и действенность вакцины против COVID-19 – слон (не) в комнате
Эффективность вакцины обычно выражается в виде снижения относительного риска (RRR). В нем используется относительный риск (RR) — т. е. соотношение частоты поражений с вакциной и без нее, — который выражается как 1–RR. Ранжирование по заявленной эффективности дает снижение относительного риска на 95% для вакцин Pfizer-BioNTech, 94% для Moderna-NIH, 91% для Gamaleya, 67% для J&J и 67% для вакцин AstraZeneca-Oxford. Тем не менее, RRR следует рассматривать на фоне риска заражения и заболевания COVID-19, который варьируется между популяциями и с течением времени. Хотя RRR учитывает только участников, которым может быть полезна вакцина, абсолютное снижение риска (ARR), которое представляет собой разницу между показателями заболеваемости с вакциной и без нее, учитывает все население. ARR, как правило, игнорируются, потому что они дают гораздо менее впечатляющий размер эффекта, чем RRR:
Другими словами, почти все население мира было привито различными вакцинами против COVID-19, чтобы снизить реальный риск заболевания менее чем на два процента.
Но подождите, может быть еще хуже. По словам Стива Кирша, дающего показания FDA, вакцины на самом деле могут убивать больше людей, чем спасать:
Сенсационные показания доктора Стива Кирша на слушаниях по вакцинам FDA — 3681
Данные Великобритании показывают, что вакцинированные все еще болеют COVID-19:
Отчет о эпиднадзоре за вакциной против COVID-19, неделя 42
Итак, какую цель на самом деле имеет эта вакцина?
Сделка с дьяволом.
Вот условия, на которых наши правительства купили вакцину Pfizer:
Утечка документа раскрывает «шокирующие» условия международных соглашений Pfizer о вакцинах.
Просочившийся документ, раскрытый пользователем Twitter Ehden, раскрывает шокирующие условия международных соглашений Pfizer о вакцинах против COVID-19.
Страны, приобретающие прививку Pfizer от COVID-19, должны признать, что «усилия Pfizer по разработке и производству продукта» «связаны со значительными рисками и неопределенностями».
В случае появления лекарства или другого лечения, которое может предотвратить, вылечить или вылечить COVID-19, соглашение остается в силе и страна должна выполнить свой заказ на вакцину.
В то время как вакцины от COVID-19 «бесплатны» для получения в США, они оплачиваются долларами налогоплательщиков по ставке 19,50 долларов за дозу — Албания, как выяснилось из просочившегося контракта, заплатила 12 долларов за дозу.
Покупатель вакцины Pfizer против COVID-19 также должен признать два факта, которые в значительной степени замалчивались: как их эффективность, так и риски неизвестны.
Покупатели также должны «возмещать убытки, защищать и ограждать Pfizer… от любых исков, претензий, исков, требований, убытков, убытков, обязательств, расчетов, штрафов, штрафов, издержек и расходов… возникающих в связи с или в связи с в результате вакцины».
PFIZERLEAK: РАЗОБЛАЧЕНИЕ СОГЛАШЕНИЯ О ПРОИЗВОДСТВЕ И ПОСТАВКАХ PFIZER.
Pfizer очень агрессивно пытается защитить детали своих международных соглашений о вакцинах против COVID-19.
К счастью, мне удалось получить один.
Другие производители вакцин заключили аналогичные контракты с нашими правительствами.
Клинические испытания этих вакцин также проводились в спешке и были сопряжены с мошенничеством и неправомерными действиями.
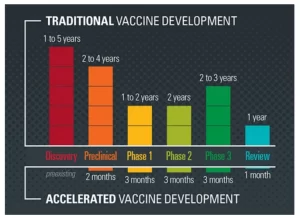
Была ли спешка с вакцинами против COVID-19? Вот как вакцины были разработаны так быстро.
5. Перекрывающиеся фазы.
Регулирующие органы в Управлении по санитарному надзору за качеством пищевых продуктов и медикаментов и те, кто занимается созданием этих вакцин, уже видели научные результаты на платформе мРНК-вакцин. Таким образом, исследователи могли сосредоточить свои вопросы на животных моделях и ранних испытаниях на людях, чтобы они были завершены быстрее. В некоторых случаях имело место наложение определенных этапов исследования.
Испытание вакцины Pfizer не было двойным слепым:
Чего Эд и другие, похоже, еще не осознали, так это того, что это была проблема не только в изолированном центре: все испытание изначально даже не планировалось как двойное слепое. Оно было объявлено исследованием «слепым наблюдателем», что якобы означало, что исследователи не знают, кто получает лечение, а реципиенты знают или могут знать. В этом случае Pfizer заявила, что внешний вид жидкости во флаконах с вакциной отличался от флаконов с плацебо, поэтому медсестры, делающие инъекции, знали разницу, а испытуемые могли узнать об этом или понять это самостоятельно. Медсестра не должна была рассказывать другим исследователям, кто есть кто. А если никто из исследователей не знает, то они могут назвать это исследованием «слепого наблюдателя».
Компания, которая управляла сайтами испытаний вакцины Pfizer, «сфальсифицировала данные»: осведомитель
Брук Джексон, региональный директор, нанятый исследовательской группой Ventavia, сообщил British Medical Journal , что компания «фальсифицировала данные, не ослепляла пациентов, нанимала недостаточно обученных вакцинаторов и медленно отслеживала побочные эффекты», о которых сообщалось в опорном исследовании III фазы. вакцины Pfizer-BioNTech.
Несмотря на то, что Брук Джексон неоднократно уведомляла Ventavia о проблемах, компания, как сообщается, не предприняла никаких корректирующих действий. Это побудило Джексон отправить жалобу по электронной почте в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) — высший регулирующий орган страны — в сентябре 2020 года. Но менее чем через 24 часа Ventavia уволила ее в явной мести.
Еще одним сюрпризом стало то, что FDA также не отреагировало на жалобу Джексона. Хотя регулирующий орган утверждает, что у него нет кадров для активного мониторинга и расследования всех клинических испытаний, один человек сказал BMJ , что был удивлен тем, что агентство не проверило Ventavia даже после того, как сотрудник подал жалобу.
Было бы ужасно, если бы какое-либо лекарство было протестировано и продано в таких условиях, но для фармацевтических гигантов продвигать яд таким образом, при широком одобрении наших политиков, просто немыслимо.
Нераскрытые ингредиенты.
Многочисленные группы, в том числе Рикардо Дельгадо и La Quinta Columna, Андреас Ноак (который, к сожалению, по слухам, погиб из-за всего этого) и UNIT, заявили, что вакцины против COVID-19 содержат неизвестные графеновые наночастицы. Они исследовали флаконы с вакциной с помощью рамановской спектроскопии и сканирующего электронного микроскопа и пришли к выводу, что внутри них находятся чешуйки графена различной формы и размера.
Немецкий химик, доктор Андреас Ноак, найден МЁРТВЫМ после того, как обнаружил оксид графена в «вакцинах» Covid
д-р Доменико Бискарди очередная смерть разоблачителя вакцин от Covid.
Гражданин Великобритании 2021
UNIT – Краткий отчёт о клиническом случае и лабораторный отчёт.
Этот последний документ также доступен через IPFS в нецензурируемой форме:
ipfs://QmaW7qKcE9Q7iATx3caLWQ8fhRfmdP2JM6rrYn8nLkbK69
Графен способствует окислительному стрессу в организме и может влиять на функцию нейронов. Известно, что графен, введенный в мозг мышей, снижает их восприятие угрозы (то есть оказывает анксиолитическое действие):
Успокоение симптомов тревоги с помощью оксида графена:
Оксид графена прерывает сигналы нейронов, связанные с тревогой, не затрагивая нейроны или окружающие клетки. Проще говоря, он только «отключает» связь между определенными нейронами. При заболевании, при котором эти связи чрезмерно выражены, например при посттравматическом стрессовом расстройстве и тревоге, воздействия на синапсы оксидом графена достаточно, чтобы остановить развитие этого патологического поведения. Это тип прецизионной медицины.
Графен также может стать основой технологии «нейронного кружева» и использоваться для мониторинга нейронной активности.
ACS — влияние графена на жизнеспособность ненейрональных и нейрональных клеток и стресс:
Клеточная биосовместимость графена подчеркивает потенциал графена для использования в биомедицинских приложениях, обеспечивая долгосрочные и стабильные ненейронные и нейронные интерфейсы, особенно в области биоэлектроники для изучения нейронной электрофизиологии.
Frontiers — взаимодействие материалов на основе графена с нервными клетками:
Научное сообщество стало свидетелем экспоненциального роста применения графена и материалов на его основе в самых разных областях, от инженерии до электроники, биотехнологий и биомедицинских приложений. Что касается нейронауки, то эти материалы вызывают двойной интерес. С одной стороны, нанолисты из графена или производных графена (оксид графена или его восстановленной формы) можно использовать в качестве носителей для доставки лекарств. Здесь важным аспектом является оценка их токсичности, которая сильно зависит от состава чешуек, химической функционализации и размеров. С другой стороны, графен можно использовать в качестве подложки для тканевой инженерии. В этом случае проводимость, вероятно, является наиболее значимой среди различных свойств различных графеновых материалов. поскольку это может позволить инструктировать и опрашивать нейронные сети, а также управлять ростом и дифференцировкой нейронов, что имеет большой потенциал в регенеративной медицине. В этом обзоре мы пытаемся дать всестороннее представление о достижениях и новых задачах в этой области, а также о том, какие направления, по нашему мнению, являются наиболее интересными в ближайшем будущем. К ним относится необходимость создания многофункциональных наночастиц (НЧ), способных преодолевать гематоэнцефалический барьер, достигать нервных клеток и обеспечивать доставку конкретных лекарств по требованию. Мы описываем современное состояние использования графеновых материалов для создания трехмерных каркасов для стимулирования роста и регенерации нейронов. мы пытаемся дать всестороннее представление о достижениях и новых задачах в этой области, а также о том, какие направления, по нашему мнению, являются наиболее интересными в ближайшем будущем. К ним относится необходимость создания многофункциональных наночастиц (НЧ), способных преодолевать гематоэнцефалический барьер, достигать нервных клеток и обеспечивать доставку конкретных лекарств по требованию. Мы описываем современное состояние использования графеновых материалов для создания трехмерных каркасов для стимулирования роста и регенерации нейронов. мы пытаемся дать всестороннее представление о достижениях и новых задачах в этой области, а также о том, какие направления, по нашему мнению, являются наиболее интересными в ближайшем будущем. К ним относится необходимость создания многофункциональных наночастиц (НЧ), способных преодолевать гематоэнцефалический барьер, достигать нервных клеток и обеспечивать доставку конкретных лекарств по требованию. Мы описываем современное состояние использования графеновых материалов для создания трехмерных каркасов для стимулирования роста и регенерации нейронов. и для обеспечения доставки конкретных лекарств по требованию. Мы описываем современное состояние использования графеновых материалов для создания трехмерных каркасов для стимулирования роста и регенерации нейронов. и для обеспечения доставки конкретных лекарств по требованию. Мы описываем современное состояние использования графеновых материалов для создания трехмерных каркасов для стимулирования роста и регенерации нейронов.in vivo , а также возможность использования графена в качестве компонента гибридных композитов/устройств многослойной органической электроники. И последнее, но не менее важное: мы обращаемся к необходимости точного теоретического моделирования интерфейса между графеном и биологическим материалом, моделируя взаимодействие графена с белками и клеточными мембранами в наномасштабе и описывая физический механизм (механизмы) переноса заряда с помощью что различные графеновые материалы могут влиять на возбудимость и физиологию нервных клеток.
Другими словами, если эти вакцины содержат графен, а также белок, способный нарушить гематоэнцефалический барьер и потенциально доставить графен через него, это весьма подозрительно по многим причинам.
Но, почему они это делают?
Почему наши правительства вынуждают миллиарды невинных людей под угрозой потери работы и запрета на поездки и развлекательные заведения принимать вакцину, произведенную с использованием новой и непроверенной технологии, которая, как уже было показано, вызывает целый ряд крайне вредных для здоровья людей? побочные эффекты?
Они не могут не знать обо всем этом. На данный момент можно почти с уверенностью сказать, что продолжающееся настаивание наших правительств на нашей прививке буквальным ядом и безжалостное уничтожение альтернативных медиа, противоречащих их повествованию, являются актами преднамеренного и преднамеренного злого умысла.
Зачем им это с нами, скажете вы? Что ж, твоя догадка так же хороша, как и моя.
С другой стороны, я знаю, что преступники уже заявили о своих намерениях несколько десятилетий назад.
Устранение этих кровожадных преступников и страдающих манией величия с постов власти и власти над нами потребует огромной силы воли. Это битва, в которой мы все уже сражаемся во всем мире.
Мы все боремся за свою жизнь.
— Спартак
ХОТИТЕ ЗНАТЬ НА СКОЛЬКО ПЛОХА ВАША ПАРТИЯ ИНЪЕКЦИИ ПРОТИВ ГРИППА ФАУЧИ (Covid-19) — пройдите по этой ссылке и УЗНАЙТЕ ПРЯМО СЕЙЧАС!
Последние новости, о происходящем в мире, всегда можете найти и прочитать на сайте worldgnisrael.com
ВИДЕО: СОСТАВ ВАКЦИНЫ по ДАННЫМ СДС.
https://dailyexpose.uk/2022/03/20/new-spartacus-covid-19-deep-dive-part-ii-vaccine-complications/
Михаэль Лойман